En el anterior post comentamos las diferentes técnicas convencionales de obtención de organismos transgénicos, aunque cada día se avanza más en la investigación y surgen nuevas técnicas revolucionarias sobre la modificación dirigida del genoma. Si bien lo hemos ido nombrando a lo largo de las publicaciones anteriores de este blog, hoy os hablaremos de la tecnología de edición génica CRISPR/Cas9, así como de su origen y aplicaciones en el campo de los alimentos transgénicos.
¿Qué es CRISPR/Cas9 y de dónde surgió?
La tecnología CRISPR/Cas9 es una novedosa herramienta molecular que se utiliza para modificar de una forma dirigida y específica regiones del genoma de las células. El nombre proviene de las siglas en inglés Clustered Regularly Interspaced Short Palindromic Repeats, lo que en español sería “Repeticiones Palindrómicas Cortas Agrupadas y Regularmente interespaciadas”. La segunda parte del nombre (Cas9) está relacionado con un conjunto de proteínas encargadas de cortar el ADN (nucleasas), por lo que se les llamó CRISPR associated system, es decir, «sistema asociado a CRISPR».
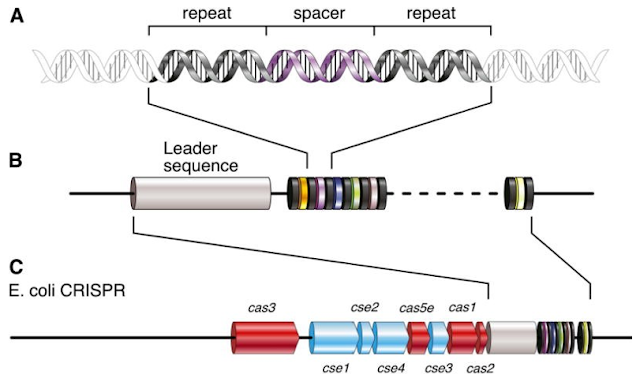
Ahora bien, esta tecnología surgió a partir del hecho observado en 1987 de que algunos microorganismos eran capaces de defenderse de algunas infecciones víricas. Se llegó a la conclusión de que estos microorganismos poseían unas enzimas (un tipo de proteínas) capaces de diferenciar entre el material genético propio y el del virus que las infectaba, destruyendo este último. Cuando se investigó más a fondo, se encontraron unas secuencias en su genoma muy repetidas que eran palindrómicas (que se leen igual al derecho que al revés) y que no poseían una función aparente. Estas repeticiones estaban separadas entre sí por unas secuencias que actuaban como “espaciadores”. Delante de todas estas secuencias había una región a la que se denominó “líder”. Por lo tanto, el nombre CRISPR hace referencia a estas secuencias palindrómicas repetidas y separadas regularmente. Además, muy cerca de esta construcción se encuentran los genes que codificaban las proteínas Cas. Esta disposición se puede apreciar en la siguiente imagen, que muestra las secuencias CRISPR y Cas de la bacteria Escherichia coli.
La relación de esta construcción con la resistencia a virus reside en que los espaciadores que separan las secuencias palindrómicas son fragmentos de ADN de anteriores virus que intentaron infectar al microorganismo. Cuando las secuencias CRISPR son transcritas a ARN, las proteínas Cas cercanas las cortan y se asocian a uno de los fragmentos. En el caso de que un virus infecte de nuevo al microorganismo, los complejos formados por Cas y el ARN son capaces de reconocer el ADN viral por complementariedad (el ADN viral se “pega” al ARN). El resultado de esta interacción es la inactivación y posterior degradación del material genético exógeno. La célula es capaz incluso de
incorporar alguno de los fragmentos del ADN del virus como un nuevo espaciador, por lo que la inactivación futura de ese mismo virus será más efectiva tanto para el microorganismo como para su descendencia. Es como si fuera un sistema inmune propio de la célula que se adapta y recuerda infecciones pasadas.
incorporar alguno de los fragmentos del ADN del virus como un nuevo espaciador, por lo que la inactivación futura de ese mismo virus será más efectiva tanto para el microorganismo como para su descendencia. Es como si fuera un sistema inmune propio de la célula que se adapta y recuerda infecciones pasadas.
No fue hasta el año 2012 en el que se presentaron evidencias de que esta característica biológica podía convertirse en una herramienta molecular de utilidad en el laboratorio.
¿Cómo funciona?
La bondad de esta técnica es que se puede sustituir el espaciador por cualquier otra secuencia de interés, por lo que en lugar de cortar el ADN de un virus infectivo puede cortar en una región específica del genoma celular. Podemos diseñar una molécula de ARN (ARN guía) a conciencia para que sea complementaria a una secuencia del ADN celular, la cual una vez en el interior del núcleo sea capaz de asociarse con la nucleasa Cas9. El complejo Cas9/ARN guía encontrará y reconocerá la secuencia de ADN propio, momento en el que realiza un corte en ambas cadenas.
Ahora bien, la célula se da cuenta de que el ADN ha sufrido un corte e intenta repararlo, por medio de uno de los siguientes mecanismos de reparación:
- Unión de extremos no homólogos (NHEJ). La célula intenta reparar la ruptura añadiendo o quitando nucleótidos de una de las cadenas en ambos extremos hasta que las cadenas sean compatibles en algún punto y se unan, ya que necesita un molde en el que apoyarse. Una vez que se emparejan, la maquinaria celular es capaz de repararlas y unirlas. Durante este proceso se generan inserciones o deleciones de unos pocos nucleótidos (indel), por lo que si afecta a un gen es muy probable que altere su expresión o que directamente deje de ser funcional.
- Reparación directa por homología (HDR). En este caso, la ruptura de las cadenas se soluciona utilizando un fragmento de ADN donante que sea complementario a ambos extremos. La célula reconoce esta interacción y reemplaza la región dañada por la molécula donante.
¿Para qué sirve?
Las aplicaciones de esta tecnología son casi inimaginables, ya que permite alterar, editar o corregir el genoma de cualquier célula de una manera rápida, fácil, barata y con mucha precisión. Hemos visto que según se repare el corte por un mecanismo u otro se dan diferentes resultados.
Los indels producidos por la NHEJ pueden ser utilizados para estudiar la función de los genes al crear modelos celulares o animales, ya que su inactivación permite ver los efectos que tenía el gen en el organismo cuando era funcional. Del mismo modo, puede utilizarse para inactivar genes defectuosos de las células que tengan efectos perjudiciales en el organismo.
 Si se usa esta técnica junto con la adición de cadenas de ADN ajenas, es posible sustituir secuencias de ADN del genoma por otras que nos interesen. Dado que durante la HDR se utiliza un fragmento de ADN donante, es posible diseñar secuencias de ADN “a la carta” para que sean complementarias con la zona que va a ser cortada y que además incorporen secuencias específicas.
Si se usa esta técnica junto con la adición de cadenas de ADN ajenas, es posible sustituir secuencias de ADN del genoma por otras que nos interesen. Dado que durante la HDR se utiliza un fragmento de ADN donante, es posible diseñar secuencias de ADN “a la carta” para que sean complementarias con la zona que va a ser cortada y que además incorporen secuencias específicas.
Estas nuevas secuencias incorporadas al genoma podrían curar enfermedades genéticas al incorporar la versión funcional de un gen, aunque también pueden utilizarse secuencias que expresen genes con funciones adicionales a los que tenía el organismo. Es aquí donde entran en juego los alimentos transgénicos, ya que esta tecnología permite incorporar al genoma secuencias de ADN procedentes de otras especies para dotar de nuevas capacidades a los organismos modificados. CRISPR/Cas9 ha sido probada en muchos cultivos y está dando muy buenos resultados, ya sea aumentando los rendimientos de los cultivos de arroz o modificando el color de las zanahorias. Ya no solo alimentos, sino que los seres vivos modificados por CRISPR/Cas9 serían capaces de producir otras muchas sustancias de gran importancia para sociedad de un forma ecológica y sostenible: biocombustibles, materiales y químicos, medicamentos, etc.
Una de las noticias más actuales con más repercusión sobre el CRISPR/Cas9 ha sido la de He Jiankui, un investigador chino que aseguró haber creado los primeros bebes usando la herramienta de edición genética CRISPR, para que los niños sean inmunes al virus del VIH, la viruela y el cólera. Sin embargo, esta noticia se ha topado con el rechazo unánime de toda la comunidad científica, ya que no está permitida la manipulación genética de embriones humanos.
Francisco Mojica, el padre de CRISPR
 El descubrimiento de las secuencias repetidas responsables de la inmunidad adaptativa de los microorganimos fue obra de Francisco Mojica, profesor del departamento de Fisiología, Genética y Microbiología de la Universidad de Alicante (España). Mojica trabajó en los años 90 con estas secuencias y las bautizó como CRISPR, pero fueron las investigadoras Emmanuelle Charpentier y Jennifer Doudn las que en 2012 utilizaron este descubrimiento para llevar a cabo la tecnología de edición genética de cualquier ser vivo.
El descubrimiento de las secuencias repetidas responsables de la inmunidad adaptativa de los microorganimos fue obra de Francisco Mojica, profesor del departamento de Fisiología, Genética y Microbiología de la Universidad de Alicante (España). Mojica trabajó en los años 90 con estas secuencias y las bautizó como CRISPR, pero fueron las investigadoras Emmanuelle Charpentier y Jennifer Doudn las que en 2012 utilizaron este descubrimiento para llevar a cabo la tecnología de edición genética de cualquier ser vivo.
A pesar de este gran descubrimiento, no le ha sido concedido el Premio Nobel de Medicina. No obstante, ha recibido otros galardones de gran importancia en el mundo científico, destacando el Premio Albany de medicina en Estados Unidos y el Plus Alliance a la Innovación Global, incluyendo el de ser nombrado hijo predilecto de su ciudad natal, Elche. El motivo por el que no se le ha concedido todavía el Premio Nobel podría residir en los riesgos de esta tecnología. La técnica de edición genética CRISPR/Cas9 es muy reciente, por lo que todavía debe investigarse más a fondo para perfeccionarla.




No hay comentarios:
Publicar un comentario